Das ursprünglich rein elektrophysiologische Methodenspektrum wurde um bildgebende Verfahren weiter ergänzt und modernisiert. Dazu zählen Ca2+-Imaging und Voltage-sensitive Dye Imaging (VSDI).

Doktorandinnen und Doktoranden:
Markus Ballmann
Nour Kassab El Dine
Moxi Chen
Zhaoying Li
Jin Mengyao
MSc und BSc Studierende
Technische Assistenz:
Andreas Blaschke
Dr. vet Nina Bayer
Tier Management:
Dr. Stefanie Monecke
Neben institutseigenen Mitteln stehen Mittel der Deutschen Forschungsgemeinschaft, der fakultätsinternen Kommission klinische Forschung (KKF) und Industriegelder zur Verfügung.
Die Laborräumlichkeiten befinden sich auf dem Gelände des Klinikums rechts der Isar. Es stehen verschiedene intra- und extrazelluläre Ableitungstechniken sowie bildgebende Systeme zur Verfügung. Zur Ableitung einzelner Neuronen wird ein infrarot-gestützter Pach-Clamp Messplatz verwendet. Dieser Messplatz wurde zusätzlich durch einen UV-Laser ergänzt. Dadurch besteht nun die Möglichkeit, an visualisierten Neuronen laserinduziert Neurotransmitter freizusetzen und so im Hirnschnittpräparat die Aktivität postsynaptischer Rezeptoren zu messen. Zusätzlich ist der Messplatz mit einem Calcium Imaging System ausgestattet.
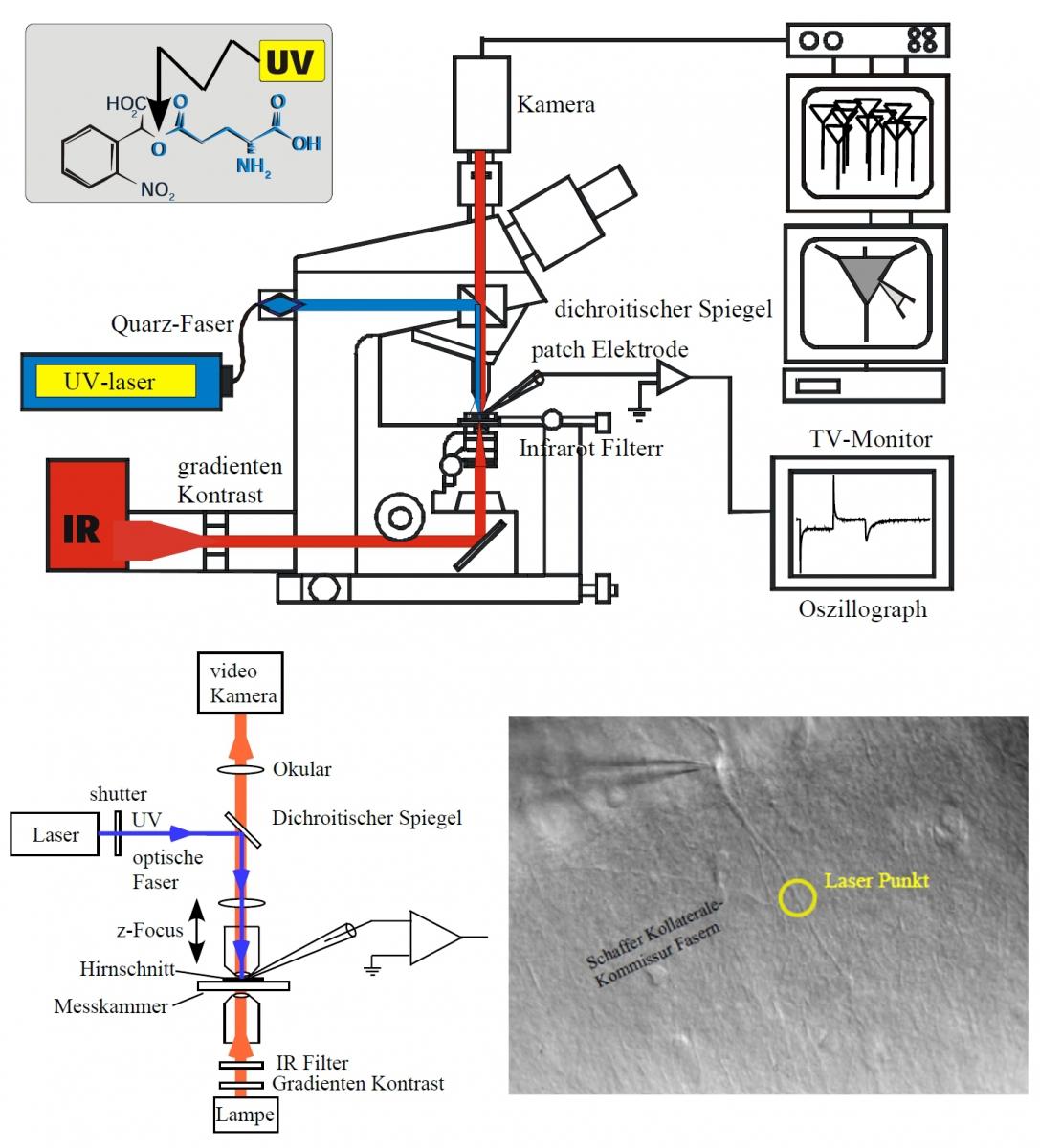
Insbesondere der Messplatz zur bildgebenden Darstellung der neuronalen Aktivität (VSDI) stellt den neuesten Stand dieser Art von Messtechnik dar. Hiermit lassen sich mit Hilfe von spannungssensitiven Farbstoffen, die sich in die Zellmembran einlagern, Erregungsausbreitungen über ein großflächiges Hirnschnittareal beobachten. Diese Aufnahmetechnik dient vor allem dazu, die für die Anästhesie relevante thalamokortikale Aktivität unter Einfluss verschiedener Anästhetika zu untersuchen. Des Weiteren kann die Ausbreitung der neuronalen Aktivität im tri-synaptischen Schaltkreis des Hippocampus verfolgt werden und somit die Wirkung verschiedener Pharmaka auf Netzwerkebene erforscht werden. Darüber hinaus können, ausgelöst durch afferente Stimulation, an einem Messplatz für extrazelluläre Messtechniken die synaptische Summenaktivität von Neuronen im Hirnschnittpräparat untersucht werden.

Die Arbeitsgruppe beschäftigt sich vorrangig mit der Wirkung von zentral wirksamen Pharmaka auf neurophysiologische und neurodegenerative Mechanismen. Der Schwerpunkt unserer Untersuchungen liegt hierbei auf Prozessen, relevant für Lernen und Gedächtnis, sowie der b-Amyloid induzierten Neurotoxizität bei der Alzheimer Erkrankung. Bei dieser Erkrankung gilt die synaptische Schädigung durch b-Amyloid als eine der wesentlichen Ursachen des irreversiblen Untergangs von Neuronen und als zentrales pathophysiologisches Korrelat der für diese Erkrankung charakteristischen fortschreitenden Demenz.
Im Speziellen werden intravenöse, gasförmige und volatile Anästhetika auf die Funktion von spannungsabhängigen Ionenkanälen sowie auf die synaptische Transmission und synaptische Plastizität im Hippocampus, Neocortex und in der Amygdala der Maus untersucht.
Unter dem Aspekt dementer Erkrankungen (Fokus Alzheimer Erkrankung) wird die physiologische Wirkung von Anästhetika, Benzodiazepinen und zentral wirksamen Neurosteroiden auf die toxische Wirkung des b-Amyloid Proteins (Ab) charakterisiert. Ebenso untersuchen wir die Auswirkung einer Anästhesie auf die kognitive Leistung in vivo im Allgemeinen und unter dementen Bedingungen (Alzheimer Erkrankung).
Mittels histologischer, molekularbiologischer, biochemischer, bildgebender und elektrophysiologischer Techniken soll geklärt werden, inwiefern Anästhetika, Benzodiazepine und Neurosteroide die synaptotoxische Wirkung von b-Amyloid beeinflussen.
Ebenso interessieren wir uns für die von Astrozyten und Mikroglia kontrollierte Phagozytose von dendritischen Dornfortsätzen. Diese Prozesse dienen der Synapsen-Bildung sowie -Eliminierung und spielen damit eine wichtige Rolle bei der Regulation der synaptischen Aktivität. Eine wichtige physiologische Bedeutung haben hier die Proteine C1q, C3, Nectin, Megf10 und MERKT. Da die kognitive Leistung eng mit der Anzahl und Funktionstüchtigkeit von dendritischen Dornfortsätzen zusammenhängt, untersuchen wir den Einfluss von verschiedenen Anästhetika und b-Amyloid auf diese Mechanismen.
Zusätzlich können für unsere Experimente Adeno-assoziierte Viren (AAVs) eingesetzt werden um in eine bestimmte neuronale Population (z.B. Parvalbumin Interneurone) Gene zu transferieren, die es erlauben die neuronale Aktivität genau dieses Neuronentyps zu steigern oder zu inhibieren. Dadurch lässt sich dann die Funktion dieser Neurone bei bestimmten physiologischen Prozessen (z.B. zelluläre Prozesse verantwortlich für Lernen und Gedächtnis) charakterisieren.
Anästhetika:
- Volatile Anästhetika:
- Wechselwirkung von Isofluran und Sevofluran mit der synaptischen Transmission und synaptischer Plastizität in unterschiedlichen Hirnregionen
- Einfluss von Isofluran und Sevofluran auf Lernen und Gedächtnis
- Isofluran, Sevofluran und POCD (Postoperative kognitive Defizite): Mögliche Langzeitauswirkungen einer Anästhesie auf zelluläre Prozesse, verantwortlich für Lernen und Gedächtnis.
- Interneurone und Anästhesie: Bestimmen spezifischer Typen von Interneuronen als Stellglieder GABAerger Modulatoren und pharmakologischer Zielstrukturen (Kollaboration mit Prof. Antkowiak, Tübingen)
- Xenon:
- Wechselwirkung von Xenon mit der synaptischen Transmission und synaptischer Plastizität in unterschiedlichen Hirnregionen
- Wie beeinflusst Xenon thalamokortikale Schaltkreise: Elektrophysiologische Untersuchungen und Darstellung mit bildgebenden Verfahren (VSDI)
- Können für Xenon – im Vergleich zu Sevofluran und Propofol – in vitro positive Eigenschaften in Bezug auf Lernen und Gedächtnis nachgewiesen werden? Dazu wird die Langzeitpotenzierung in Hippocampusschnitten der Maus unter physiologischen und pathologischen Bedingungen, wie durch Zugabe des synaptotoxischen Aß, untersucht.
- Welche Auswirkungen hat Xenon, im Vergleich zu volatilen Anästhetika, auf die Synapseneliminierung?
Perioperatives Management:
Die Definition einer perioperativen Anästhesiebehandlung hat sich in den letzten Jahren entscheidend gewandelt. Ausgehend von einem kurzen perioperativen Zeitfenster wurde sie auf eine Langzeitbeobachtung erweitert, um das Auftreten von postoperativem Delirium (POD) und postoperativen kognitiven Defiziten (POCD) zu vermeiden. Präoperative Risikofaktoren wie Demenz, affektive Störungen oder Stress-assoziiert Erkrankungen, die per se schon negativ auf kognitive Funktionen wie Lernen und Gedächtnis einwirken, können die Entwicklung von POD und POCD begünstigen.
Folgende Fragestellungen sind daher relevant:
- Kann ein präoperatives EEG-Monitoring zur Erfassung der Schlafcharakteristika als prädiktiver Biomarker zur Identifizierung von Risikogruppen (z.B. bei einer Alzheimer Demenz oder einer gestörten neuroendokrinen Stressreaktivität oder Depression) für die Entwicklung von POD und POCD nach einer Anästhesie dienen? Dabei sollen sowohl kurzfristige als auch langfristige Auswirkungen der Anästhesie auf die Hirnaktivität, Emotionalität und kognitive Funktionen in den Blick genommen werden. (Kollaboration mit Prof. Chadi Touma (Osnabrück), PD Dr. Thomas Fenzl (MRI, TUM).)
Neuroprotektion:
- Modulation von GABA(A) Rezeptor Untereinheiten durch Neurosteroide und Anästhetika: Identifizierung der molekularen Bindungsstellen entscheidend für Neuroprotektion. (Kollaboration mit Prof. Antkowiak, Tübingen.)
- Klärung der molekularen, zellulären und systemischen Unterschiede von Benzodiazepinen und Neurosteroiden. Inwieweit sind verschiedene Klassen von Interneuronen an einer Veränderung der Netzwerkaktivität durch Benzodiazepine und Neurosteroide beteiligt. Wie werden dadurch zelluläre Mechanismen für Lernen und Gedächtnis beeinflusst. Am Beispiel der Alzheimer Pathophysiologie wollen wir der Vermutung nachgehen, dass der Einsatz von Neurosteroiden, nicht Benzodiazepinen, bei einer neurodegenerativen Vorschädigung vorteilhafter ist und vor weiterer Degeneration schützt. (Kollaboration mit Prof. Antkowiak, Tübingen.)
- Untersuchungen zur Bedeutung des Perineuronalen Netzes (PNN) bei physiologischen und pathophysiologischen Prozessen (z.B. long-term potentiation (LTP) und b-Amyloid Toxizität). (Kollaboration mit Prof Peter Noakes (University of Queensland, Brisbane).)
Morbus Alzheimer und Morbus Parkinson:
- Einfluss von niedrig dosierten Glutamat-Rezeptor Antagonisten auf die Toxizität von b-Amyloid: in vivo und in vitro Experimente zu Lernen und Gedächtnis
- Wechselwirkung von Aggregationshemmern mit b-Amyloid: in vitro und in vivo Experimente in hippokampalen Hirnschnitten. Kollaboration mit Dr. H. Russ (Galimedix Therapeutics).
- Wechselwirkung von IAPP (Inselzellen Amyloid Polypeptit)-Analoga mit ß-Amyloid: in vitro Experimente in hippokampalen Hirnschnitten. (Kollaboration mit Prof. Dr. A. Kapurniotu, TUM.)
- Verbessern Neurosteroide die neurokognitiven Fähigkeiten in unterschiedlichen Krankheitsstadien bei Tieren eines transgenen Mausmodells der Alzheimer'schen Erkrankung? Bedeutung einer TSPO abhängigen Neurosteroidfreisetzung auf Abeta-induzierte synaptotoxische Wirkung - Fokussierung auf Prozesse relevant für Lernen und Gedächtnis. (Kollaboration mit Prof. Dr. Jochen Herms (DZNE, München).)
- Untersuchungen zur Funktion des astrozytären TSPO-Proteins bei Morbus Alzheimer in Verbindung mit Anästhesie. In diesem Projekt sollen astrozytäre Kalzium-Oszillationen in vivo analysiert werden. Ziel ist es zu wissen: (1) Inwiefern astrozytäre Kalzium-Oszillationen durch neurodegenerative Prozesse in Abhängigkeit einer Anästhesie verändert werden und (2) ob diese gestörte astrozytäre Funktionalität abhängig ist von der TSPO-Rezeptor Aktivierung und mit Neurosteroid-basierenden Therapieansätzen beeinflusst werden kann. Ein Verständnis dieser Mechanismen soll helfen zu verstehen, warum eine Anästhesie die Manifestation einer neurodegenerativen Erkrankung triggert und ob dieses durch eine präventive oder perioperative Therapie auf der Basis von Neurosteroiden vermieden werden kann. (Kollaboration mit Prof. Dr. Jochen Herms (DZNE, München).)
- Kann das Narkosegas Xenon als schwacher NMDA-Rezeptor-Antagonist die Toxizität verschiedener Ab-Spezies in vitro und in vivo abschwächen bzw. aufheben? Dieser Fragestellung wird über die Untersuchung hippokampaler Langzeitpotenzierung und neurodegenerativen Mechanismen bei der Maus nachgegangen.
Anxiolyse:
- Pharmakologische Untersuchungen zur Substanz XBD173, ein Aktivator des Translokatorproteins (TSPO 18kD)
- Ist die Substanz XBD173 eine Alternative zu Benzodiazepinen im perioperativen Management? Vergleichende Untersuchung von XBD173 und Midazolam auf Anxiolyse, Lernverhalten und Gedächtnis bei jungen und alten Mäusen.
Tumorforschung:
- Untersuchungen zur Kompensation der strahleninduzierten Inflammation durch inflammationshemmende Substanzen: Dabei sollen unter anderem die neurophysiologische Vitalität und Funktionalität an Hirnschnittpräparaten des Hippocampus von Mäusen nach der Bestrahlung und potentiell kompensatorische Effekte von Fenofibrat und Cannabidiol auf die Hirnfunktion untersucht werden. (Kollaboration mit Prof. Dr. Gabriele Multhoff (MRI, TUM).)
- Wie beeinflussen Tumorzellen die neuronale Aktivität zur Unterstützung der Tumorproliferation beim Pankreas Karzinom? Hier untersuchen wir mit Hilfe von Patch-Clamp und Calcium Imaging die elektrische Kommunikation an einer peripheren Krebszell-Neuron-Synapse um die Funktion und mögliche therapeutische Maßnahmen zu charakterisieren. (Kollaboration mit Prof. Dr. Ekin Demir (MRI, TUM).)
Anxiolyse und Neuroprotektion durch TSPO Aktivierung und Neurosteroidfreisetzung:
- Rainer Rupprecht, Prof. Dr. med., Chefarzt, Bezirksklinikum Regensburg, Universitätsstraße 84, 93053 Regensburg
- Christian Wetzel, Prof. Dr. rer. nat., Abteilung Psychiatrie und Psychotherapie, Regensburg, Universitätsstraße 84, 93053 Regensburg
Therapeutische Ansätze zum Pathomechanismus des ß-Amyloid Proteins:
- Galimedix Therapeutics
Neurogeneration:
- Jochen Herms, Prof. Dr. med., Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE), Feodor-Lynen Str. 17, 81377 München
- Stephan Lichtenthaler, Prof. Dr., Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE), Feodor-Lynen-Str. 17, 81377 München
- Peter Noakes, Prof. Dr., School of Biomedical Sciences, University of Queensland, Australia
GABA(A)-Rezeptoren und Neuroprotektion:
- Bernd Antkowiak, Prof. Dr. rer. nat., Universität Tübingen, Waldhörnlestraße 22, 72072 Tübingen
Inselzellen Amyloid Polypeptid:
- Aphrodite. Kapurniotu, Prof. Dr. rer. nat., Technische Universität München, Emil-Erlenmeyer-Forum 5, 85354 Freising-Weihenstephan
Tumorforschung:
- Gabriele Multhoff, Prof. Dr. rer. Nat., Experimentelle Radioonkologie und Strahlenbiologie, Klinikum rechts der Isar, München.
- Ekin Demir, Prof. Dr. med., Chirurgische Klinik, Klinikum rechts der Isar, München.
Altunkaya, A., Deichsel, C., Kreuzer, M., Nguyen, D. M., Wintergerst, A. M., Rammes, G., Schneider, G., Fenzl, T., 2024. Altered sleep behavior strengthens face validity in the ArcAbeta mouse model for Alzheimer's disease. Sci Rep 14, 951.
Hofmann, C., Sander, A., Wang, X. X., Buerge, M., Jungwirth, B., Borgstedt, L., Kreuzer, M., Kopp, C., Schorpp, K., Hadian, K., Wotjak, C. T., Ebert, T., Ruitenberg, M., Parsons, C. G., Rammes, G., 2021. Inhalational Anesthetics Do Not Deteriorate Amyloid-beta-Derived Pathophysiology in Alzheimer's Disease: Investigations on the Molecular, Neuronal, and Behavioral Level. J Alzheimers Dis 84, 1193–1218.
Kassab, N. E. D., Mehlfeld, V., Kass, J., Biel, M., Schneider, G., Rammes, G., 2023. Xenon’s Sedative Effect Is Mediated by Interaction with the Cyclic Nucleotide-Binding Domain (CNBD) of HCN2 Channels Expressed by Thalamocortical Neurons of the Ventrobasal Nucleus in Mice. Int J Mol Sci 24.
Lennartz, P., Tholke, D., Bashiri Dezfouli, A., Pilz, M., Lobinger, D., Messner, V., Zanth, H., Ainslie, K., Kafshgari, M. H., Rammes, G., Ballmann, M., Schlegel, M., Foulds, G. A., Pockley, A. G., Schmidt-Graf, F., Multhoff, G., 2023. Biomarkers in Adult-Type Diffuse Gliomas: Elevated Levels of Circulating Vesicular Heat Shock Protein 70 Serve as a Biomarker in Grade 4 Glioblastoma and Increase NK Cell Frequencies in Grade 3 Glioma. Biomedicines 11.
Pigoni, M., Hsia, H. E., Hartmann, J., Rudan Njavro, J., Shmueli, M. D., Muller, S. A., Guner, G., Tushaus, J., Kuhn, P. H., Kumar, R., Gao, P., Tran, M. L., Ramazanov, B., Blank, B., Hipgrave Ederveen, A. L., Von Blume, J., Mulle, C., Gunnersen, J. M., Wuhrer, M., Rammes, G., Busche, M. A., Koeglsperger, T., Lichtenthaler, S. F., 2020. Seizure protein 6 controls glycosylation and trafficking of kainate receptor subunits GluK2 and GluK3. Embo J 39, e103457.
Pradhan, A. K., Neumuller, T., Klug, C., Fuchs, S., Schlegel, M., Ballmann, M., Tartler, K. J., Pianos, A., Garcia, M. S., Liere, P., Schumacher, M., Kreuzer, M., Rupprecht, R., Rammes, G., 2023. Chronic administration of XBD173 ameliorates cognitive deficits and neuropathology via 18 kDa translocator protein (TSPO) in a mouse model of Alzheimer's disease. Transl Psychiatry 13, 332.
Pradhan, A. K., Rupprecht, R., Rammes, G., 2024. Translocator protein and neurodegeneration: insights from Alzheimer’s disease. Neural Regeneration Research.
Puig-Bosch, X., Ballmann, M., Bieletzki, S., Antkowiak, B., Rudolph, U., Zeilhofer, H. U., Rammes, G., 2023. Neurosteroids Mediate Neuroprotection in an In Vitro Model of Hypoxic/Hypoglycaemic Excitotoxicity via delta-GABA(A) Receptors without Affecting Synaptic Plasticity. Int J Mol Sci 24.
Puig-Bosch, X., Bieletzki, S., Zeilhofer, H. U., Rudolph, U., Antkowiak, B., Rammes, G., 2022. Midazolam at low nanomolar concentrations affects long-term potentiation and synaptic transmission predominantly via the alpha1-GABAA receptor subunit in mice. Anesthesiology 136, 954-969.
Rupprecht, C., Rupprecht, R., Rammes, G., 2021. C1q, a small molecule with high impact on brain development: putative role for aging processes and the occurrence of Alzheimer's disease. Eur Arch Psychiatry Clin Neurosci.
Russ, H., Mazzanti, M., Parsons, C., Riemann, K., Gebauer, A., Rammes, G., 2022. The Small Molecule GAL-201 Efficiently Detoxifies Soluble Amyloid β Oligomers: New Approach towards Oral Disease-Modifying Treatment of Alzheimer’s Disease. Int J Mol Sci 23.
Shi, D., Wong, J. K. Y., Zhu, K., Noakes, P. G., Rammes, G., 2023. The Anaesthetics Isoflurane and Xenon Reverse the Synaptotoxic Effects of Aβ1–42 on Megf10-Dependent Astrocytic Synapse Elimination and Spine Density in Ex Vivo Hippocampal Brain Slices. Int J Mol Sci 24.
Shi, Q., Wang, X., Pradhan, A. K., Fenzl, T., Rammes, G., 2024. The Effects of Sevoflurane and Aβ Interaction on CA1 Dendritic Spine Dynamics and MEGF10-Related Astrocytic Synapse Engulfment. Int J Mol Sci 25.
Shi, Y., Cui, M., Ochs, K., Brendel, M., Strübing, F. L., Briel, N., Eckenweber, F., Zou, C., Banati, R. B., Liu, G.-J., Middleton, R. J., Rupprecht, R., Rudolph, U., Zeilhofer, H. U., Rammes, G., Herms, J., Dorostkar, M. M., 2022. Long-term diazepam treatment enhances microglial spine engulfment and impairs cognitive performance via the mitochondrial 18 kDa translocator protein (TSPO). Nature neuroscience 25(3), 317-329.
Taş, K., Volta, B. D., Lindner, C., El Bounkari, O., Hille, K., Tian, Y., Puig-Bosch, X., Ballmann, M., Hornung, S., Ortner, M., Prem, S., Meier, L., Rammes, G., Haslbeck, M., Weber, C., Megens, R. T. A., Bernhagen, J., Kapurniotu, A., 2022. Designed peptides as nanomolar cross-amyloid inhibitors acting via supramolecular nanofiber co-assembly. Nature Communications 13.
Wang, X., Shi, Q., Pradhan, A. K., Ziegon, L., Schlegel, M., Rammes, G., 2022. Beta-Site Amyloid Precursor Protein-Cleaving Enzyme Inhibition Partly Restores Sevoflurane-Induced Deficits on Synaptic Plasticity and Spine Loss. Int J Mol Sci 23, 6637.
